Bolsista:
Líria Amanda
Olá
Pessoal!
Na matéria passada, sobre
“Fenol e fenóis, suas utilizações, parte I”, falamos do fenol no tratamento de
infecções e também alguns fenóis naturais encontrados nas especiarias e os
fenóis artificiais, como o ácido pícrico que foi utilizado em armamentos, pelos
ingleses. Hoje, iremos falar sobre o fenol na construção de objetos e sobre um
fenol para sabor. Vejamos a seguir como esse composto
trouxe grandes benefícios para nossa vida.
Quase na mesma época que
Lister (descrito na matéria anterior) fazia experiências com ácido carboxílico,
a produção de pentes, talheres, botões e caixas, peças de jogo de xadrez e
chaves de piano, que eram feitas do marfim retirado do cerne de elefantes,
aumentavam grandemente. Matava-se um número maior de elefantes, por causa de
suas presas, o marfim estava escasso e caro. Devido à alta demanda do produto,
e o jogo de bilhar se tornar popular, as reservas de marfim estavam se esgotando.
Precisava de um produto artificial que poderia substituí-lo. Então foi
utilizado a celuloide, um polímero baseado na celulose, tornando-se o primeiro
material termoplástico.
O problema é que os
polímeros por base de celulose são inflamáveis, principalmente os que são
envolvidos por nitrocelulose, causando explosões. Em 1897, ocorreu um incêndio
no cinema de Paris, pois a indústria cinematográfica ao fazer o filme,
utilizava o polímero de celulose feito de nitrocelulose. Mas nunca aconteceu de
uma bola de bilhar explodir, mesmo assim, era um risco para a segurança.
No início do século XX, o
belga Leo Baekeland emigrara para os Estados Unidos. Baekeland desenvolveu a
primeira versão sintética do material que chamamos de plásticos, inaugurando a
Idade dos Plásticos.
Baekeland, após desenvolver
um papel fotográfico, conseguiu uma boa renda para criar uma versão sintética
da goma-laca, que era utilizada para conservar a madeira. A goma-laca é
produzida por besouros e demorava seis meses para ser produzido. Devido à alta
demanda, viu-se a necessidade de criar uma goma-laca artificial.
Primeiramente, Baekeland fez
combinações do fenol com o formaldeído, mas os materiais ficavam quebradiços e
inflexíveis, tendo nenhuma utilidade. Em 1907, Baekeland conseguiu obter um
líquido que endurecia rapidamente, tornando uma substância sólida e
transparente, cor de âmbar. Então Baekeland denominou-a de baquelita (ver na
figura 1). Descobriu-se que a baquelita era um material ideal para a fabricação
de bola de bilhar, pois era muito semelhante ao marfim. Em pouco tempo a
baquelita estava por toda parte, como nos aparelhos de telefone, tigelas,
agitadores de máquina de lavar, tubos de cachimbo, móveis e entre diversos
objetos.
Figura 1: A
formação da baquelita
Fonte: Polímeros
reações de polimerização.
Assim como a a baquelita, uma
substância artificial que foi criada para substituir uma substância natural,
outras substâncias também foram criadas para atender a falta da demanda, como
por exemplo, a vanilina retirada da orquídea baunilha. Então, fabricaram a
vanilina sintética a partir do resíduo líquido gerado no tratamento da polpa de
madeira, com sulfito. Tal resíduo possui uma substância encontrada nas paredes
das células das plantas, essa substância chama-se lignina, que contribui para a
rigidez das plantas.
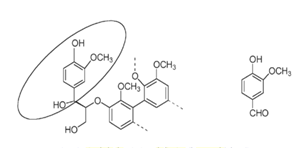
Na figura 2, vemos o desenho
da lignina, o círculo na ilustração destaca a parte da estrutura que é muito
semelhante à da molécula da vanilina. Quando a molécula de lignina é quebrada
sob condições controladas, pode produzir a vanilina.
Figura 2: estrutura
da lignina (à esquerda) semelhante à molécula da vanilina (à direita).
Fonte: Os Botões de
Napoleão
A vanilina sintética possui
o sabor e o aroma pleno da verdadeira baunilha, pois é retirada de uma fonte natural.
Nesses dois capítulos vimos
a importância do fenol e sua vasta utilização no mundo industrial. Espero que
tenham gostado, até a próxima!
Referências
[1]
COUTEUR. P. BURRESON. J. Os Botões de Napoleão: as 17 moléculas que
mudaram a história. - Rio de Janeiro: Zahar, 2006.
[2]
ALBERTO. R. Curso de química industrial.
Polímeros reações de polimerização. Disponível em: http://www.ebah.com.br/content/ABAAAfWVgAI/2012-1-aula-04-polimeros-reacoes-polimerizacao Acesso em: 21/12/2015.


Nenhum comentário:
Postar um comentário