MINERAIS:
DEFINIÇÃO, ORIGEM E CLASSIFICAÇÃO
Segundo Press (2006), os minerais são
sólidos naturais formados por conjuntos de átomos com estrutura atômica e composição
química fixada, mas, não definida, devido à existência de elementos traços
presentes fora da rede cristalina. Eles compõem a parte unitária das rochas. A
figura 1 apresenta exemplos de alguns minerais. Veja mais aqui.
Figura 1. Clinoclase Crocoíta Halita
azul
Fonte:
Mesquita, (2014).
O granito, por exemplo, é uma rocha composta
essencialmente por três minerais, quartzo, feldspato e mica. Esses minerais se
encontram aproximadamente em toda a crosta terrestre, mas estão presentes
também no manto e no núcleo interno (PRESS, 2006).
A crosta terrestre tem uma espessura de aproximadamente 40
quilômetros, dividida em crosta continental e crosta oceânica, sendo que esta
última possui menor comprimento, mas maior densidade, isso por causa da
composição química. A maioria dos minerais que formam a crosta continental são
elementos menos densos, silício, alumínio, sódio, potássio, entre outros. É
justamente nessa área que se encontram as zeólitas (WATERCEL, 2013).
Segundo Press (2006), o oxigênio é o elemento mais
abundante da crosta da terra, aproximadamente 46%, formando um arranjo com
outros átomos mais abundantes como o silício, alumínio e outros elementos traços,
portanto, nesse ambiente haverá a formação de minerais constituídos por esses
elementos. Eles se formam por três processos:
Processos magmáticos;
Precipitação de sais;
Recristalização de
sólidos.
Em relação ao resfriamento do magma, quando ele se
desloca até a superfície traz consigo muitos elementos, que se resfriam
originando minerais. Já
na precipitação de sais o processo de constituição de minerais vai depender do coeficiente
de solubilidade de
cada sal (PRESS, 2006).
Na água do mar, por exemplo, se é separada uma quantidade
para evaporação, o primeiro cristal a se formar será o sulfato de cálcio (CaSO4),
logo depois precipitará carbonato de cálcio (CaCO3) em seguida o
próximo mineral a se originar será a halita, mas conhecido como cloreto de sódio (NaCl), os próximos a se formarem
serão o cloreto
de potássio (KCl) e cloreto
de magnésio (MgCl2), esses últimos com vantagens econômicas,
sendo que os minerais que se formam a partir desse processo são chamados de
evaporitos (WATERCEL,
2013).
De acordo com Watercel
(2013), existem muitos lugares no mundo que possuem depósitos evaporíticos,
considerando-se alguns como, mar
morto, nas lagoas salinas que há no deserto do Atacama e também no Brasil situado no Pantanal em épocas de seca. O último processo
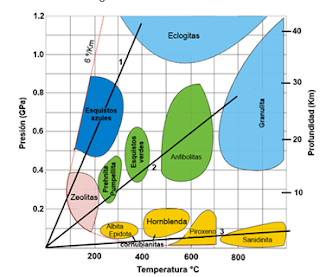
é conhecido como metamorfismo, essa ação ocorre no interior da terra a altas
temperaturas e pressão. Cada grupo de mineral se estabiliza em uma área especifica
de temperatura e pressão, as zeólitas, por exemplo, se formam em um local de
temperatura e pressão baixa. Cada zona recebe o nome do respectivo mineral
formado, como pode ser observado na figura 2.
Figura 2. Zonas metamórficas
Fonte: Search, (2016).
Watercel (2013), diz que
à classificação dos minerais, se estabelece fundamentalmente por meio da
composição química. Através da presença do radical aniônico ou das
características de cada elemento nativo, que se define a que grupo o mineral pertence,
isso por causa da semelhança de propriedades, a título de exemplo, todo
carbonato reage a um ácido, não importando se é carbonato de cálcio (CaCO3)
ou carbonato de ferro (FeCO3).
Dentre as várias classificações de
minerais como, elementos nativos, sulfetos, sulfossais,
óxidos e Hidróxidos, haloides, carbonatos, nitratos, boratos, fosfatos,
sulfatos, tungstatos e silicatos,
esse último é o mais importante, não economicamente, mas por causa da grande
quantidade, mais de 90% dos minerais que constitui a crosta são grupos de
silicatos, dentre eles estão à classe das zeólitas, que juntamente com outros
minerais representam 3% do total (WATERCEL,
2013).
SILICATOS
A estrutura básica de qualquer silicato é constituída por
um cátion de silício (Si4+) e quatro ânions de oxigênio (O2-),
formando um tetraedro (UFRN, 2015). No entanto, ocasionalmente o átomo de Si
pode ser substituído por um de alumínio (Al3+), originando
aluminossilicatos. Os minerais se caracterizam por possuírem estruturas neutras,
porém o silício possui valência 4+ e o oxigênio 2-,
logo, o tetraedro constituído por esses átomos necessitará se
ligar a outros cátions para obter neutralidade (PEREIRA, 2012).
Dessa forma dependendo do grau de polimerização, figura 3 e 4, ou seja, da
quantidade de compartilhamento de oxigênio entre os tetraedros, será definida
diferentes classificações de silicatos (UFRN, 2015), como: Nesossilicatos:
tetraedros isolados (SiO4)-4; Sorossilicatos: duplas de tetraedros
(Si2O7)-6;
Ciclossilicatos: anéis de tetraedros (Si6O18)-12 ou
(SiO3)-2; Inossilicatos:
cadeias simples de tetraedros e cadeias duplas de tetraedros (Si2O6)-4, (Si4O11)-6;
Filossilicatos: folhas de tetraedros (Si2O5)-2 e Tectossilicatos:
arranjo tridimensional (SiO2)
no qual todos os átomos de oxigênio são compartilhados, sendo essa a
classe das zeólitas e outros minerais (WATERCEL, 2013).
Figura 3.
Grau de polimerização dos silicatos
Fonte: UFRN, (2015).
Figura 4.
Grau de polimerização dos silicatos
Fonte: UFRN, (2015).
ZEÓLITAS: ORIGEM E ESTRUTURA
Sabe-se que parte da crosta
terrestre é formada por minerais, ou seja,
cerca de 95% é constituída por minerais do grupo dos silicatos,
aluminossilicatos. Muitos materiais da construção civil são constituídos por
silicatos: granito, tijolos, cimento, cerâmica, vidro e muitos outros ( SHINZATO,
2007).
Os
três elementos que estão em maior quantidade são O, Si e Al. Somados formam
aproximadamente 81% da crosta terrestre (LEE, 1999b). As zeólitas fazem parte
do grupo de alumino-silicatos hidratados de metais alcalinos e
alcalino-terrosos. Tiveram
origem por meio do resfriamento do magma e podem aparecer em fendas de rochas
magmáticas, e também como parte integrante de rochas que sofreram reações
químicas e em rochas sedimentares (SHINZATO, 2007), são formadas por:
Figura 5. Estrutura zeolítica
Fonte: UFRN, (2015).
A primeira zeólita (a estilbita, NaCa2Al5Si13O36.
14H2O) foi descoberta em 1756,
pelo mineralogista sueco, Freiherr
Axel Frederick Cronstedt, esse mineral liberava água quando aquecido por uma chama.
A esta nova classe de minerais (aluminossilicatos hidratados), Cronstedt
denominou de zeólita, derivada das palavras gregas “zeo” (ferver) e “lithos”
(pedra), ou seja, “pedra que ferve”, devido a sua característica peculiar de
liberar bolhas ao serem imersas em água (GUISNET; RIBEIRO, 2004).
A fórmula geral que pode representar a composição química
das zeólitas é Mx/n[(Al2O3)x(SiO2)y] ·wH2O,
onde n é a valência do cátion M (que pode ser um metal dos grupos 1 ou 2 da
tabela periódica ou um composto orgânico); x+y é o número total de tetraedros
de SiO4 e AlO4- por malha elementar; e w é o
número de moléculas de água (MÜLLER, 2013).
Durante duzentos anos as zeólitas foram usadas
predominantemente como joias e expostas em museus por causa da beleza dos seus
cristais.
O surgimento das zeólitas sintéticas e
a descoberta de bacias sedimentares, fez com que esse panorama alterasse,
possibilitando a sua utilização em numerosas outras aplicações (GUISNET;
RIBEIRO, 2004).
Em 1920 que sua estrutura,
porosidade e seletividade foram estudadas. Nesta mesma década, estudiosos Weigel
e Steinhoff sugeriram que nas zeólitas existiam poros,
dessa maneira poderia inserir exclusivamente substâncias com tamanhos
definidos, ou seja, substâncias menores que os poros das zeólitas. Em vista
deste comportamento, em 1932, McBain, propôs o termo peneira
molecular para materiais que exibissem adsorção seleta de
compostos, tal como as zeólitas (MÜLLER, 2013).
Resultado de pesquisas do
ano de 2005 mostrou que 56 zeólitas naturais já foram determinadas, e os
maiores depósitos desses minerais se encontram na China. São mais utilizados
nas indústrias de matérias de construção, em caixas de dejetos de animais e
também como material adsorvente de resíduos em efluentes (MÜLLER, 2013). Para a
padronização dos variados tipos minerais de zeólitas, houve a necessidade de
classificação das diferentes espécies, feita pela (International Zeolite
Association, 2004) foi estabelecido um código para diferentes tipos de zeólitas
encontradas naturalmente, que consiste de três letras maiúsculas. Como exemplos
a laumontita = LAU, a heulandita = HEU, estilbita = STI, philipsita = PHI entre
outros (SOUZA, 2000). A figura 6 ilustra duas zeólitas naturais e suas
respectivas estruturas.
Figura
6. Zeólitas naturais
Fonte:
Watercel, (2013).
Já as zeólitas sintéticas, foram desenvolvidas
mais de 150, em que 60% delas são usadas em detergentes para tratamento de
águas duras, como na remoção de íons como Ca2+. As zeólitas retiram
os íons Ca2+ e os substituem por Na+; e assim removem a
“dureza da água” (LEE, 1996a).
No entanto, a síntese de
zeólita está amplamente em aberto, uma vez que avaliações teóricas indicam a
possibilidade de uma quantidade bem mais elevada de estruturas zeolíticas
(GUISNET; RIBEIRO, 2004).
PROPRIEDADES
DAS ZEÓLITAS
Pelo fato de possuir uma
composição com elevada semelhança e alto teor de pureza, os tipos de zeólitas
sintéticas são muito utilizadas como catalisadores, enquanto as naturais, no
tratamento de efluentes (AGUIAR et al. 2002).
É importante lembrar que devido ao baixo custo
das zeólitas naturais, houve grande estímulo, proporcionando um avanço na
criação de sistemas de tratamento mais baratos (DUARTE et al. 2002). As principais aplicações das zeólitas
estão relacionadas as:
Troca
Iônica
Segundo Ribeiro (2005) o processo
de troca iônica nas zeólitas é feito pela substituição
direta dos cátions de compensação, como o sódio, que neutraliza a carga
negativa que se encontra associada aos íons de alumínio tetracoordenados da
estrutura zeolítica, por cátions da solução. Isso pode ser percebido pela
utilização dos minerais zeólitas na remoção de Ca+ ou Mg2+
da água
dura através da
troca iônica, liberando Na+, dessa forma os detergentes têm
uma maior eficiência, visto que, os íons adsorvidos não irão mais reagir com
eles (SPIRO e STIGLIANI, 2009).
A troca iônica é
necessária para a obtenção da zeólita na forma ácida, por isso, usa-se o método
indireto que implica na troca de íons da zeólita com determinados íons (por
exemplo, NH4+), o qual quando aquecido se decompõe originando
prótons na zeólita, na qual irão conferir sua propriedade
ácida (RIBEIRO, 2005). Como ilustra a figura 7.
Figura 7. Acidez das
zeólitas
Fonte: UFRN, (2015).
Devido a limitações em sua estrutura, a troca iônica na
zeólita alcança cerca de 70% dos cátions de Na+. Os cátions não
trocados estão posicionados nos prismas hexagonais, pois os cátions NH4+
não conseguem penetrar nestes prismas (RIBEIRO, 2005). Segundo Sherman (1984),
existem diversos fatores que influenciam o processo de troca iônica: natureza,
tamanho e carga do cátion, temperatura, pH, concentração
do cátion em solução e quantidade do alumínio contido na estrutura. Na
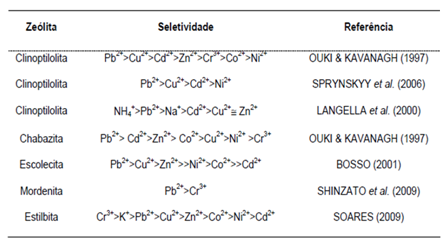
tabela 1 pode-se verificar a seletividade dos metais para diferentes zeólitas
naturais.
Tabela 1. Série de
seletividade dos metais em solução pelas zeólitas naturais verificada em alguns estudos.
Fonte: Oliveira, (2011).
Adsorção
O processo de adsorção se
configura pela transferência de massa, onde a matéria de uma fase fluida (gás,
vapor ou líquido) se deposita sobre uma superfície, normalmente uma fase
sólida. A adsorção é um fenômeno de superfície, sendo caracterizado em duas
fases: o adsorvente e o adsorbato. Intitula-se adsorvente a substância, cuja
superfície (interna e/ou externa) se realiza o processo de adsorção e adsorbato
é a substância que está presa pelo adsorvente (VACLAVIK, 2010).
O potencial de adsorção das zeólitas depende do seu
volume poroso e do diâmetro dos poros. Uma das principais propriedades das
zeólitas é o comprimento de poros, seus microporos possuem aberturas de 0.4 a
0.8 nm e são constituídos por canais e/ou cavidades de tamanho limitado
(VACLAVIK, 2010).
Um exemplo de adsorção com zeólitas pode ser
observado quando utilizada em auxílio aos conversores
catalíticos usados em carros, que são ineficazes quando o motor está frio, pois eles requerem
temperatura de 300°C para ocorrer as reações, com isso uma boa quantidade de
hidrocarbonetos saem pelo escapamento sem serem devidamente tratados. Com a
utilização das zeólitas esse problema é reduzido, uma vez que, elas adsorvem os
hidrocarbonetos em uma temperatura baixa para só depois, quando a temperatura
ultrapassar os 300°C, libera-los para o conversor catalítico (SPIRO e STIGLIANI
2009).
Regeneração
Geralmente, após os materiais adsorventes já estarem
saturados, eles são submetidos a processos de regeneração. Estudos apresentam
etapas de regeneração em que se utilizam soluções regenerantes (comumente
ácidos e bases), possibilitando, dessa forma, a reutilização deste material
(OLIVEIRA, 2006). Porém, com esse tipo de tratamento, o material vai se
degradando aos poucos, fazendo com que, sua estrutura seja prejudicada,
caracterizando assim, uma limitação na utilização destes materiais. Em vista
disso, os adsorventes estão sendo cada vez mais valorizados (VACLAVIK, 2010).
Existem diversos métodos sobre a recuperação do
adsorvente saturado, como o co-processamento e a
recuperação de metais, que visa, a recuperação de elementos de grande valor
(MENDONÇA, 2005) e sua reutilização na aplicação dos adsorventes como
constituintes de produtos que não têm propriedades de adsorção (OLIVEIRA,
2006).
O co-processamento, ou seja, a destinação final adequada
de resíduos, é à solução mais citada pelas agências ambientais do mundo, sendo
que, o estudo da regeneração de zeólitas usadas como catalizadores na indústria
petroquímica é muito discutido e fornece resultados satisfatórios (AFONSO,
2006).
A partir do emprego
precursor das zeólitas em 1962 em técnicas de craqueamento de petróleo ,
permitiu hoje a apropriação da posição de catalisadores mais significativos na
indústria química (CORMA, 1997 apud LUNA & SCHUCHARDT, 2001) . As zeólitas são tidas como os
catalisadores mais propícios na procura de eficiência e
soluções de problemas para o químico moderno. O artifício desse catalisador utópico
funcionaria como um selecionador molecular, deixando cada molécula de substrato
favorável ao rompimento apenas da ligação química apropriada à formação do produto
desejado com ótima execução e seletividade perfeita (SHELDON, 1997 apud LUNA & SCHUCHARDT, 2001).
De
acordo com Luna e Schuchardt (2001), a competência das zeólitas em catálise se
deve a alguns aspectos específicos desses materiais. Zeólitas contém: ampla
área superficial e propriedade de adsorção, podendo se comportar como hidrofóbicas
ou como hidrofílicas; um arranjo tridimensional que possibilita a
obtenção de sítios ativos, como os sítios ácidos que, dependendo do produto
desejado, é possível variar a força e concentração; diâmetro de canais e
cavidades que permitem a passagem de grande parte das moléculas das
matérias-primas utilizadas na indústria; e um conjunto de canais que lhes
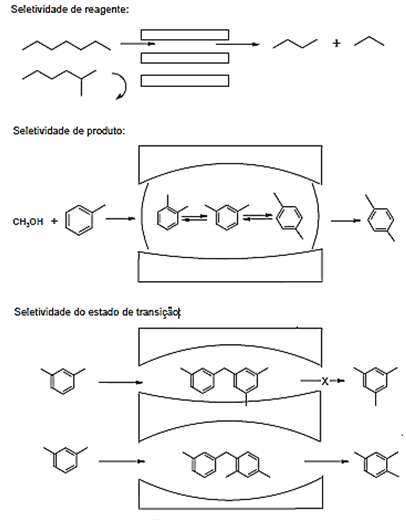
possibilitam adsorver variados tipos de formas e tamanhos; “seletividade de
reagente, de produto e de estado de transição” (LUNA & SCHUCHARDT, 2001. p.
885), como representados na figura 8.
Figura 8. Tipos de seletividade com peneiras
moleculares.
Fonte: Luna;
Schuchardt, (2001).
A seletividade nas zeólitas pode ser empregada para ocasionar
uma reação catalítica na direção do produto desejado, desviando de outras
reações não desejadas. Devido à aproximação induzida (figura 9) entre reagentes
sob a ação dos potenciais eletrostáticos presentes nos canais e cavidades
ocasiona a diminuição da energia de ativação necessária à ocorrência da
catálise (BOND, 1987 apud LUNA & SCHUCHARDT, 2001).
Figura 91.
Transporte com “bomba molecular.”
Fonte: Luna;
Schuchardt, (2001).
Segundo Sheldon
(1993), as zeólitas podem ser melhoradas por meio de modificações variadas,
objetivando um aprimoramento considerável do seu funcionamento e seletividade catalítica.
A alteração de zeólitas pela inserção de metais de transição originam as
“peneiras redox”. “Estes compostos, que, em tese, possuiriam atividade e
mecanismo comparáveis àqueles encontrados em enzimas,
podem ser considerados, grosso modo, “enzimas minerais” ou “zeozimas”“.
(LUNA & SCHUCHARDT, 2001. p. 888).
O hidrocraqueamento é utilizado nas indústrias para
transformar as partes mais densas oriundas da destilação do petróleo em gasolina e demais combustíveis líquidos. Normalmente,
os catalisadores são constituídos de um ácido sólido (zeólita, sílica-alumina
amorfa, ou alumina), possuindo uma parte hidrogenante como, Pt, Pd, entre
outros (LUNA & SCHUCHARDT, 2001).
1
Figura
8. (i) Reagentes apolares são
adsorvidos por uma zeólita hidrofóbica; (ii) a reação catalítica ocorre
no interior das cavidades; (iii) os
produtos polares são expelidos da zeólitas.
REFERÊNCIAS:
AFONSO,
J. C.; PONTES, A. B.; SANTOS, E. S.; MENEZES, M. S.; AGUIAR, R. M.; Reciclagem
química de zeólitas comerciais desativadas. Química nova, v. 27, n.2,
p.315-319, 2004.
AGUIAR, M.R.M.P.; NOVAES, A.C.;
GUARINO, A.W.S. 2002. Remoção de metais pesados de efluentes industriais por
aluminossilicatos. Química Nova, 25(6B): 1145-1154.
BOND, G. C. Heterogeneous Catalysis: Principles and Applications,
2nd ed, Clarendon, Oxford, 1987. Disponível em:
https://books.google.com.br/books?id=4setN8dj09oC&pg=PA292&lpg=PA292&dq=BOND,+G.+C.+Heterogeneous+Catalysis: Acesso em: 11 de
maio de 16.
CORMA,
A. Chem. Rev. 1997, 97.
p. 2373-2420. Disponível em:
DUARTE, A.C.P.; MONTE, M.B.M.; LUZ,
A.B.; LEAL, G.P. 2002. Aplicação de zeólita natural como adsorvente de metais
pesados presentes em efluentes industriais. CETEM - Comunicação técnica
elaborada para o XIX Encontro Nacional de Tratamento de Minérios e Metalurgia
Extrativa em Recife (PE), no período de 26 a 29 de novembro de 2002, 8 p.
GUISNET,
M.; RIBEIRO, F.R. Zeólitos um nanomundo ao serviço da catálise. Lisboa: Fundação
calouste Gulbenkian, 2004.
LEE, J. D. Química Inorgânica não
tão concisa. 4.ed. Editora Edgard Blucher
LTDA. São
Paulo, 1996a. p. 190.
__________Química Inorgânica
não tão concisa. 5.ed. Editora Edgard Blucher LTDA. São Paulo, 1996b. p.
217.
LUNA, F. J;
SCHUCHARDT, U. Modificação de zeólitas para uso em catálise. Química Nova, vol.
24, nº 6, 2001. p. 885-892.
MENDONÇA,
L. A.; Dissertação: estudo de viabilidade técnica de recuperação de metais a
partir de zeólitas comerciais desativadas. UFRJ, Rio de Janeiro, 2005.
MESQUITA, M. J. S. Minerais, 2014. Disponível
em: <http://www.megacurioso.com.br/minerais/44882-conheca-os-30-minerios-mais-bonitos-encontrados-na-natureza.htm> Acesso em: 11 de maio de 2016.
MÜLLER,
J. M. Desenvolvimento de zeólitas por desaluminização para desidratação de
álcoois. 2013. 128 f. Dissertação (Mestrado em Química) – Instituto de
Química. Universidade de Brasília, Distrito Federal, 2013.
OLIVEIRA,
C. R. ; Dissertação: adsorção, remoção de íons sulfato e isopropilxantato em
zeólitas natural funcionalizada. UFRGS, Porto Alegre, 2006.
OLIVEIRA,
S. A. Estudo de adsorção de metais pesados em zeólitas para fins de uso em
barreira reativa, 2011. Disponível em: <www.coc.ufrj.br/index.../1225-shirlei-aparecida-deoliveira
mestrado> Acesso em: 12 de janeiro de 2016.
PEREIRA, M. L. Ativação de zeólita natural
para preparação de floculante utilizado em tratamento de água.
Dissertação.Universidade Estadual de Goiás (UEG). Anápolis, 2012. p. 31.
PRESS, Frank. et al. Para entender a Terra.
4. ed. Porto Alegre: Bookman, 2006.
RIBEIRO,
O. M. S. dos. Desenvolvimento de um modelo cinético para a reforma catalítica
do N-octano sobre o catalisador Pt/L. Campina Grande, 2005, 117p. (Trabalho de
conclusão de curso apresentado ao programa de recursos humanos da Agência
Nacional de Petróleo da Universidade Federal de Campina Grande).
SHELDON, R. A. CHEN, J. D.; DAKKA, J.; NEELEMAN, E.; [in] New
Developments in Selective Oxidation, Elsevier Publishers, Amsterdã, 1993.
SHELDON, R. A. [in] Grasselli et al. (eds.), 3rd World Congress
on Oxidation Catalysis, Elsevier, Amsterdã, 1997.
SHERMAN, J. D. Zeolites: Science and Technology. NATO ASI
Series, Serie E: Applied Sciences, v. 80, p. 587-623, 1984.
SHINZATO,
M. C. Remoção de metais pesados em
solução por zeólitas naturais: revisão crítica. Revista do instituto
geológico, São Paulo, p. 65-78, 2007.
SOUZA,
K. C. Avaliação da capacidade de remoção de metais por zeólitas e diatomitas em
solução simuladora de drenagem ácida de mina. Lages, 2000, 53p. (Dissertação apresentada
ao centro de ciências agroveterinárias, Universidade do Estado de Santa
Catarina).
SPIRO,
T. G. STIGLIANI, W. M. Química ambiental. 2. ed. São Paulo: Pearson Prentice Hall, 2009. P. 165 e 210. UFRN.
Síntese de zeólitas. Disponível em: <www.quimica.ufrn.br/quimica/download/sintesezeolitascompleto.pdf>
Acesso em: 01de junho de 2015.
UFRN. Síntese de zeólitas estudos de casos,
2015. Disponível em: <http://www.quimica.ufrn.br/quimica/download/SinteseZeolitasCOMPLETO.pdf > Acesso em: 03/05/16.
VACLAVIK,
F. D. Avaliação e otimização do uso de
zeólitas no tratamento terciário de efluentes líquidos industriais. Porto
Alegre, 2010, 71p. (Trabalho de conclusão de curso apresentado junto à
atividade de ensino “Projeto Tecnológico” do curso de química industrial da
Universidade Federal do Rio Grande do Sul).
Watercel. Zeólitas naturais origem,
propriedades e aplicações, 2013. Disponível em: <www.youtube.com/watch?v=VXdm1_PAuA0> Acesso em: 30/04/2016.
Search. zonas metamórficas. Disponível em: <https://www.google.com.br/search?q=imagens+zona+metamorfica+de+forma%C3%A7%C3%A3o+de+rochas> Acesso em: 30/04/2016.










Nenhum comentário:
Postar um comentário